2.1 Energi Panas Dalam Bidang Kedokteran
- Apabila energi panas mengenai salah satu bagian tubuh, akan menaikkan temperature daerah tersebut.
- Efek panas :
a. Fisik : menyebabkan semua zat mengalami pemuaian segala arah.
b. Kimia : Kecepatan reaksi kimia akan meningkat dengan peningkatan temperatur. Misalnya : Reaksi oksidasi, Permeabilitas membrane sel, Metabolisme jaringan.
c. Biologis : Merupakan pengggabungan dari efek panas terhadap fisik dan kimia. Misal : Peningkatan sel darah putih, Fenomena reaksi peradangan, dilatasi pembuluh darah, peningkatan tekanan kapiler, tekanan O2 dan CO¬2, penurunan pH.
i. Penerapan energi panas dalam pengobatan
a. Metode Konduksi
- “Apabila ada perbedaan temperatur antara kedua benda maka panas akan ditransfer secara konduksi yaitu dari benda yang lebih panas ke benda yang lebih dingin”.
- Pemindahan energi panas total tergantung pada luas daerah kontak, perbedaan temperatur, lama melakukan kontak, material konduksi panas.
- Contoh:
• Kantong air panas/botol berisi air panas ; efisien untuk pengobatan nyeri abdomen (perut)
• Handuk panas ; efektif untuk spasme otot, fase akut poliomyelitis.
• Turkish batsh (mandi uap) ; sebagai penyegar atau relaksan otot.
• Mud packs (lumpur panas) ; mengonduksi panas ke dalam jaringan, mencegah kehilangan panas.
• Wax bath (parafin bath) ; efisien untuk mentransfer panas pada tungkai bawah terutama orang tua. Cara Wax Bath : wax diletakkan di dalam bak dan dipanaskan sampai temperature 1150- 1200F . Kaki direndam selama 30 menit-1 jam.
• Electric Pads. Caranya : melingkari kawat elemen panas yang dibungkus asbes atau plastic. Dilengkapi dengan termostat.
- Metode konduksi bermanfaat untuk pengobatan terhadap penyakit neuritis, Sprains, Strain, Contusio, Sinusitis, Low Back Pain
b. Metode Radiasi
- Untuk pemanasan permukaan tubuh serupa dengan pemanasan dengan sinar matahari atau nyala api.
- Sumber radiasi :
a. Electric fire
• Old type fire ; Memiliki daya 750 W, range radiasi antara merah - mendekati infra red, panjang gelombang < 15.0000 A0, untuk home treatment.
• Pensil Bar tipe ; Menggunakan reflector rectangular dan shape like acoustic type.
b. Infra Merah ;
- Memakai lampu pijar berkisar antara 250 – 2000 W, diberi filter merah.
- Gelombang infra red yang dipakai antara 800 – 40.000 nm.
- Penetrasi energi / gelombang pada kulit ± 3 mm dan meningkat di permukaan kulit.
- Lebih efektif bila dibandingkan dengan metode konduksi panas, karena penetrasi energi panas ke jaringan lebih dalam.
c. Metode Elektromagnetis
Ada dua jenis :
a. Short wave diathermy (diatermi gelombang pendek)
- Digunakan pada kram otot (muscle sprain), nyeri pada intervertebrale disk, penyakit degeneratif pada persendianm radang bursa (bursitis)
- Dua macam metode elektromagnetis :
• Teknik Kondensor (Conductor technique) ; Bagian tubuh sebelah menyebelah diletakkan dua metal plate like electrode. Pada permukaan electrode diberikan larutan elektrolit. Dengan adanya aliran AC (bolak-balik), molekul tubuh menjadi agitasi karena kenaikan temperature.
• Diatermi Metode Induksi (Inductothermy) ; Bagian tubuh yang akan dipanasi, dililitkan dengan kabel, lalu dialiri listrik. Jaringan tubuh tidak berada dalam sirkuit, tetapi terletak dalam median magnet dari suatu koil. Frekuensi yang dipakai 1 MHz.
b. Micro Wave Diathermy (Diatermi gelombang mikro)
- Digunakan untuk patah tulang (Fraktur), Sprains dan Strains, Bursitis, Radang tendon, Artritis.
- Menggunakan magnetron untuk menghasilkan gelombang radio dengan osilasi pada frekuensi 900 MHz.
- Besar energinya terletak antara short wave diathermy dan infra merah.
d. Gelombang ultrasonik
- Diperoleh dari gelombang bunyi (Audible Sound) dengan frekuensi hampir 1 MHz.
- Jaringan yang akan diobati ditempeli permukaannya oleh piezo electric transduser dengan intensitas 5 W/cm2.
- Lebih efektif pada tulang dibandingkan pada soft tissue oleh karena tulang lebih banyak menyerap panas
- Bisa digunakan untuk terapi (pengobatan) dan diagnostik.







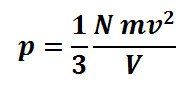

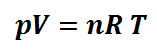
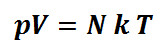

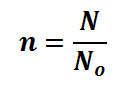


.jpg)